- Tham gia
- 25/11/2012
- Bài viết
- 351
(kenhsinhvien.vn) Cho natri vào nước, và rồi một phản ứng dữ dội, thậm chí phát nổ, sẽ xảy ra. Nhưng nguyên nhân lại cần đến vật lý lượng tử để giải thích.

Đặt một miếng kim loại natri tiếp xúc với nước sẽ tạo ra một phản ứng dữ dội, và thường phát nổ. Đó là vì natri đã góp một electron cho các ion hydro trong nước, dẫn tới toả nhiệt và tạo khí hydro. Khi khí hydro kết hợp với oxi trong không khí với sức nóng lúc bấy giờ, phản ứng cháy nổ sẽ xảy ra. Ảnh: Tavoromann/Wikimedia Commons.
Có hơi nghịch lý một chút: Khi chúng ta bắt gặp một thứ gì đó ngoài mong đợi lần đầu tiên, ta sẽ thắc mắc tại sao nó xảy ra theo cách đó. Nhưng nếu ta bắt gặp một hiện tượng thường thấy, ngay cả khi nó khiến ta ngạc nhiên và thốt lên tìm lời giải thích, thì ta chỉ đang chấp nhận rằng đó là cách thế giới này vận hành.
Cho một tinh thể muối – natri clorua đơn giản – vào nước, thì nó chỉ hoà tan.
Cho clo vào nước, bạn có thể khử trùng nước: diệt vi khuẩn, virus và các vi sinh vật gây bệnh khác có trong nước.
Nhưng nếu bạn cho natri vào nước thì sao? Phản ứng theo sau dữ dội đến khó quên.
Ngay khi bạn nhúng ướt miếng kim loại, phản ứng sẽ sủi bọt và nóng lên, natri nhảy quanh trên bề mặt nước, thậm chí còn sinh ra lửa. Hẳn rồi, đó chỉ là hoá học. Nhưng ở cấp độ cơ bản, có một hiện tượng nữa đang góp mặt: phản ứng lượng tử diễn ra giữa kim loại natri và phân tử nước (và các ion phân ly của nó) có thể xảy ra ngay sau đó. Dù rất muốn nói “đó chỉ là hoá học thôi mà”, nhưng nguyên nhân vật lý đằng sau phản ứng này lại rất hấp dẫn và chứa đựng nhiều thông tin, nhắc nhở ta đừng thôi hiếu kỳ về ngay cả hiện tượng bình thường này mà ta đã quá quen thuộc trong vũ trụ.
Dù có nhiều cách để nghĩ về nguyên tử, nhưng phản ứng hoá học diễn ra giữa natri và nước lại hợp lý nhất khi bạn cho rằng nguyên tử là “khí hiếm” với các proton thừa trong hạt nhân và electron thừa trong lớp vỏ hoá trị của chúng. Ví dụ, natri rất giống khí hiếm neon, nguyên tố thứ 10 trong bảng tuần hoàn, có 10 proton trong hạt nhân và có hai orbital đầu tiên (1s, với 2 electron) và thứ hai (2s, với 2 electron và 2p, với 6 electron) được lấp đầy bởi tổng cộng 10 electron.
Khí hiếm có tiếng là không phản ứng với bất kỳ chất nào, nguyên nhân là tất cả các orbital nguyên tử của nó đều đã chứa đủ các electron. Cấu trúc siêu ổn định này bị phá huỷ khi bạn tăng lên một nguyên tố trong bảng tuần hoàn, và điều đó xảy ra với mọi nguyên tố phù hợp với kiểu mẫu này, kể cả natri. Với một proton nữa trong hạt nhân, những orbital được lấp đầy hết electron sẽ được giữ chặt hơn, nhưng electron hoá trị thêm vào cuối cùng lại được giữ rất lỏng lẻo. Khí heli siêu ổn định, nhưng liti lại rất hoạt động. Neon ổn định, nhưng natri thì hoạt động. Tương tự argon, krypton và xenon ổn định, nhưng kali, rubidi và cesi hoạt động.
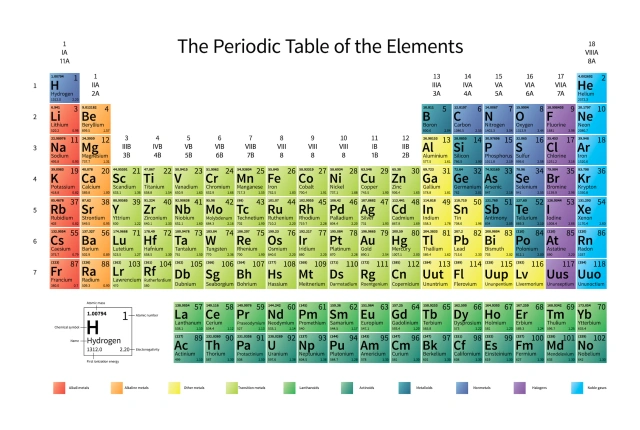
Bảng tuần hoàn các nguyên tố được sắp xếp như vậy (theo chu kỳ hàng và nhóm cột) là bởi số electron hoá trị tự do/chiếm ngự là yếu tố số một trong việc xác định tính chất hoá học của mỗi nguyên tử. Ảnh: Adobe Stock.
Nguyên nhân của khả năng phản ứng cực hạn này là gì? Đó là electron bổ sung.
Khi chúng ta học về nguyên tử, chúng ta được dạy hạt nhân là một lõi cứng, nhỏ, tích điện dương nằm ở trung tâm, và electron là các điểm tích điện âm quay quanh nó. Nhưng trong vật lý lượng tử, đó chỉ là một phần câu chuyện. Electron có thể hoạt động như một điểm, cụ thể nếu bạn bắn một hạt mang năng lượng cao khác hay photon vào electron, và để mặc cho hiện tượng xảy ra, chúng sẽ lan rộng và hoạt động như sóng. Sóng đó có thể tự cấu trúc theo những kiểu hình cụ thể:
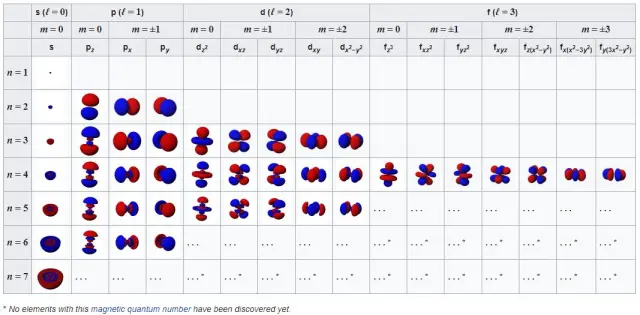
Orbital nguyên tử ở trạng thái cơ bản (góc trên bên trái), cùng với các trạng thái năng lượng thấp nhất kế tiếp khi bạn tiến dần sang phải rồi đi xuống. Những cấu trúc cơ bản này chi phối cách hoạt động của nguyên tử và lực tác dụng liên nguyên tử. Ảnh: Atomic Orbital/ English Wikipedia).
Nguyên nhân những lớp vỏ này đầy là do Nguyên lý loại trừ Pauli, ngăn bất kỳ hai fermion giống nhau nào (giống như electron) chiếm giữ cùng một trạng thái lượng tử. Bởi vì các electron sở hữu một tính chất cơ học lượng tử cơ bản gọi là spin – một đơn vị đo động lượng góc nội tại của electron. Một spin của electron có thể là +½ hoặc -½, mỗi trạng thái lượng tử duy nhất có thể có hai electron bên trong: một electron có spin +½ và một electron có spin -½.
Trong một nguyên tử, khi lớp vỏ electron hay orbital đầy hết, nơi duy nhất để đặt vào một electron bổ sung là ở orbital kế tiếp. Một nguyên tử như clo hay flo sẽ sẵn sàng nhận một electron bổ sung, vì nó chỉ cần thêm một eletron nữa để lấp đầy lớp vỏ electron; ngược lại, một nguyên tử như natri hay kali sẽ sẵn sàng nhường electron ngoài cùng của nó, vì nó thừa một electron hơn là cần lấp đầy lớp vỏ. Đó là lý do natri clorua (NaCl) là một loại muối tốt đến vậy: natri nhường clo một electron, và cả hai nguyên tử sau đó tồn tại ở cấu trúc có lợi hơn về mặt năng lượng.
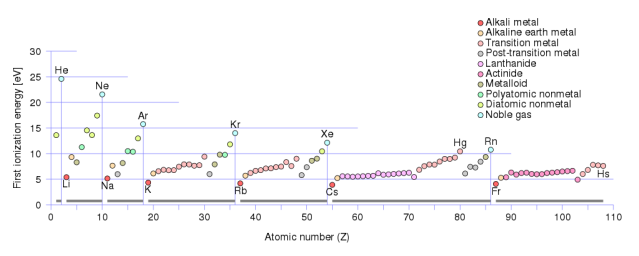
Biểu đồ cho thấy năng lượng ion hoá đầu tiên của mỗi nguyên tử trong bảng tuần hoàn xếp theo số nguyên tử. Đây là lượng năng lượng mà nguyên tử cần để tách electron được giữ lỏng lẻo nhất ra khỏi nguyên tử hoàn toàn, và ion hoá nguyên tử. Các nguyên tố trong nhóm đầu tiên của bảng tuần hoàn, như liti, natri, kali, rubidi v.v… mất electron đầu tiên dễ hơn nhiều so với các nguyên tố khác. Ảnh: Glrx/Wikimedia Commons.
Thực ra, lượng năng lượng cần thiết để một nguyên tử trung tính nhường electron lớp ngoài cùng, hay còn gọi là năng lượng điện hoá đầu tiên, rất thấp đối với các kim loại có một electron hoá trị. Nếu bạn nhìn vào những con số này, thì việc tách một electron đơn lẻ ra khỏi liti, natri, kali, rubudi, cesi, v.v… dễ hơn nhiều so với các nguyên tử khác.
Hơn nữa, khi ta nhìn vào các nguyên tố nặng dần hơn – những nguyên tố có số proton lớn hơn trong hạt nhân, và do đó sẽ có số orbital được lấp đầy hết nhiều hơn – ta sẽ thấy năng lượng ion hoá tổng thể giảm mạnh.
Tính chất ấy đóng vai trò quan trọng trong sự hình thành sao mới, dù bạn có tin hay không. Khi các sao đầu tiên hình thành, vũ trụ chỉ chứa hydro và heli khó ion hoá, nên nếu bạn không nung nóng những nguyên tố đó đến nhiệt độ đủ nóng để ion hoá chúng, thì chúng sẽ làm nguội những đám mây khí rất chậm. Điều đó dẫn tới những đám mây khối lượng lớn hình thành nên các sao khối lượng lớn; sau đó khi vũ trụ đã có nhiều nguyên tố nặng hơn, quá trình làm mát xảy ra dễ hơn do những nguyên tử dễ ion hoá dồi dào. Sau đó các sao có thể hình thành từ những đám mây khối lượng thấp hơn, tạo ra những sao khối lượng nhỏ hơn trước.
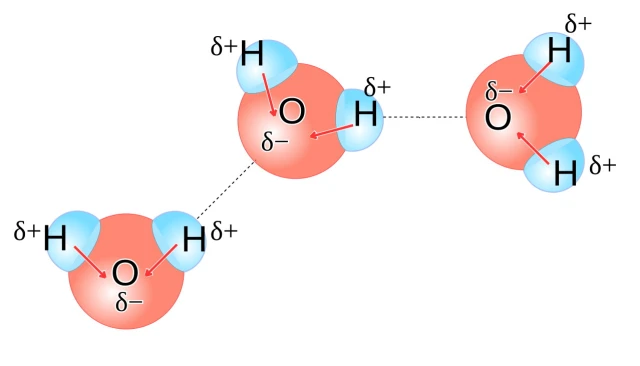
Ảnh minh hoạ tương tác giữa các phân tử nước với nhau. Nước là một phân tử dạng chữ V, có một mặt tích điện âm (vị trí nguyên tử oxi) và hai đầu tích điện dương (vị trí hai nguyên tử hydro). Các phân tử nước lân cận tương tác với nhau bằng liên kết hydro, được thể hiện bằng đường nét chấm trong ảnh. Ảnh: Wikimedia Commons.
Vậy điều gì sẽ xảy ra khi bạn cho một nguyên tử natri – một nguyên tử natri dễ bị ion hoá, chỉ giữ electron lớp ngoài cùng rất yếu ớt – vào nước?
Có thể bạn nghĩ bản thân nước là một phân tử rất ổn định: H2O, với hai hydro liên kết với một oxi. Nhưng nước là một phân tử rất phân cực, nghĩa là một mặt của phân tử H2O (mặt bên kia hai hydro) có điện tích âm, trong khi mặt đối diện có điện tích dương.
Điều đó nghĩa là mỗi phân tử nước có một đầu “tích điện âm”, nơi có oxi, và một đầu “tích điện dương” đối diện. Khi bạn có nước thể lỏng, những phân tử đó sẽ xếp thành hàng tương đối với nhau theo cách sao cho thế năng điện là nhỏ nhất, và đầu âm của phân tử nước này có thể hút đầu dương của phân tử nước khác. Đó là một hiệu ứng đủ khiến một số phân tử nước – khoảng một phần vài triệu – phân ly thành hai ion: một proton (H+) và một ion hydroxyl (OH-).

Với sự có mặt của nhiều phân tử nước phân cực cao, cứ vài triệu phân tử nước sẽ có một phân tử tách thành ion hydroxyl và proton tự do, thông qua quá trình tự phân giải. Ảnh: Cdang/Wikimedia Commons.
Hiện tượng trên có nhiều hệ quả đối với những chất như axit hoặc bazo, muối hoà tan, kích hoạt phản ứng hoá học, v.v… Nhưng điều gì sẽ xảy ra khi bạn đã có nước tinh khiết rồi, nhưng cấu tạo không chỉ từ H2O mà còn chứa một phần trăm ít ỏi (thấp hơn 0,0001%) cả proton (H+) và ion hydroxyl (OH-), và sau đó bạn thêm natri trung tính vào nó?
Natri, nguyên tử trung tính này có một electron lớp ngoài cùng lỏng lẻo, giờ đang nằm trong nước: nước trung tính nhưng phân cực, proton tự do và ion hydroxyl. Câu hỏi chúng ta phải đặt ra là cấu trúc nào có lợi nhất về mặt năng lượng?
Câu trả lời không cần phải động não; trong hầu hết mọi trường hợp, electron sẽ nhảy từ nguyên tử natri sang proton đơn lẻ đầu tiên mà nó tìm thấy.
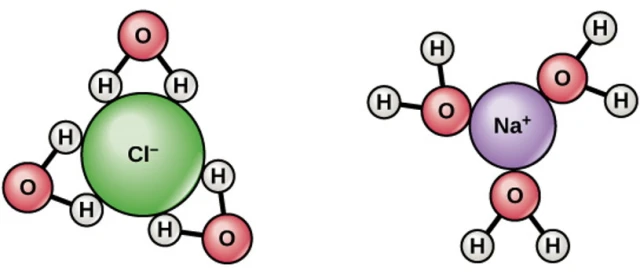
Khi mất một electron, ion natri sẽ vui vẻ hoà tan trong nước, tương tự ion clo cũng vậy khi có được một electron. Điều đó sẽ có lợi hơn nhiều về mặt năng lượng cho electron đó, trong trường hợp của natri, là khi bắt cặp với một ion hydro (một proton tự do). Ảnh: RockEDU/Đại học Rockefeller.
Thực ra chẳng có gì là khó khăn ở đây. Ở quy mô nguyên tử và ion đơn lẻ, chúng ta thường tìm câu trả lời cho những câu hỏi như “Cần bao nhiêu năng lượng để ion hoá một electron?” hay “Bao nhiêu năng lượng được giải phóng khi một electron tìm thấy một ion và tạo thành một nguyên tử trung tính ở trạng thái cơ bản?” về năng lượng trên thang đo electron-vôn (eV). Tốn nhỉnh hơn 5 eV năng lượng để ion hoá một nguyên tử natri trung tính, và khi một ion natri có được một electron, nó cũng giải phóng ~5 eV năng lượng. Nhưng cần hơn 13 eV năng lượng để ion hoá hydro trung tính, và cũng 13 eV năng lượng đó được giải phóng khi một ion hydro trung tính trở lại.
Đó là lý do phản ứng xảy ra rất nhanh khi kim loại natri được thả vào nước, và nó toả ra rất nhiều năng lượng. Trên thực tế, khi electron được natri nhường đi bắt đầu kết hợp với ion hydro, nước trung tính sẽ phân ly nhiều hơn thành những proton tự do và ion hydroxyl, tạo ra càng nhiều hơn “nhiên liệu” để natri phản ứng.
Nhưng đó cũng không phải là toàn bộ câu chuyện. Vì nguyên tử hydro trung tính đã được tạo ra, nên chúng không chỉ hình thành một khối các nguyên tử đơn lẻ có thể liên kết với nhau như kim loại natri. Thay vào đó, ở nhiệt độ phòng và áp suất phòng, hydro là một chất khí, và đi đến một trạng thái thậm chí còn có lợi hơn về mặt năng lượng: hình thành nên phân tử hydro trung tính, H2. Nên giờ đây bạn sẽ có rất nhiều năng lượng tự do (vốn đã chuyển thành nhiệt lượng xung quanh các phân tử), khí hydro trung tính thoát ra từ dung dịch chất lỏng và đi vào không khí, vốn chủ yếu là khí nito (N2) và oxi (O2) trung tính.

Máy ảnh từ xa chụp cận cảnh động cơ chính của tàu con thoi trong buổi phóng thử nghiệm tại Trung tâm Vũ trụ John C. Stennis. Khí hydro được ưa dùng làm nguồn nhiên liệu trong tên lửa vì khối lượng phân tử nhẹ và có thể phản ứng với lượng oxi dồi dào trong khí quyển. Ảnh: NASA.
Bạn nhận ra công thức quen thuộc chưa?
Bạn có nhiều năng lượng tự do dưới dạng nhiệt. Bạn có khí hydro phân tử, và bạn có khí oxi phân tử.
Đó chính là công thức để đốt động cơ! Đốt cháy hydro/oxi là một phần quan trọng của nhiên liệu tên lửa, của phương tiện pin hydro và thảm hoạ Hindenberg nổi danh. (Cũng là lý do ngày nay ta lấp đầy các khí cầu bằng khí heli trơ thay vì khí hydro dễ cháy!)
Khi oxi và hydro phản ứng với sự góp mặt của năng lượng, phản ứng nổ dữ dội này sẽ sinh ra hơi nước, nhưng cũng toả ra nhiều năng lượng hơn. Điều đó giải thích tại sao khi bạn cho một miếng natri đủ lớn (hay bất kỳ nguyên tố nhóm 1 nào từ bảng tuần hoàn) vào nước, bạn sẽ nhận được năng lượng giải phóng phát nổ kinh khủng. Đó đều là do sự chuyển giao electron, xảy ra bởi các quy tắc lượng tử chi phối vũ trụ và các tính chất điện từ của các hạt tích điện cấu tạo nên nguyên tử và ion.
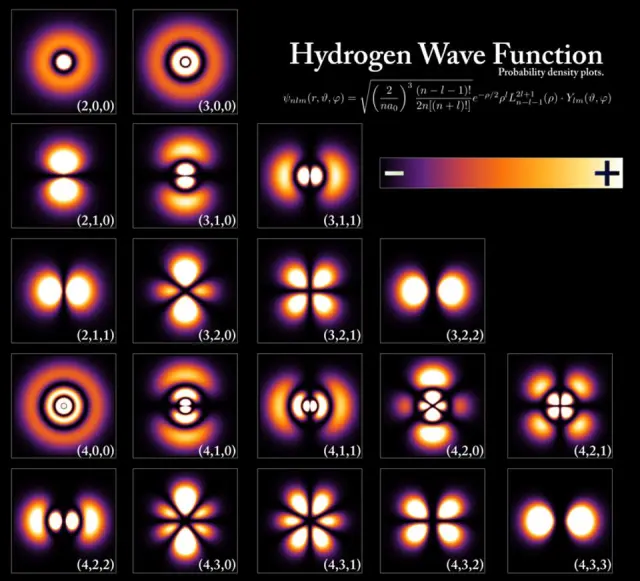
Mức năng lượng và hàm sóng electron tương ứng với các trạng thái khác nhau trong một nguyên tử hydro, dù cấu trúc là cực kỳ giống nhau đối với mọi nguyên tử. Mức năng lượng được lượng tử hoá theo bội số của hằng số Planck, nhưng ngay cả ở mức năng lượng thấp nhất thì trạng thái cơ bản cũng có hai cấu trúc khả thi phụ thuộc vào spin electron/proton tương đối. Ảnh: PoorLeno/Wikimedia Commons.
Tóm lại, khi bạn cho một miếng natri vào nước, đây là hiện tượng sẽ xảy ra.

Một thỏi kim loại natri trông khá bình thường. Nhưng bạn không được chạm vào bằng tay trần, cũng không được để nó bị ướt trừ khi bạn đã chuẩn bị đón nhận hậu quả. Natri rất hoạt động đối với nước, và kết quả là có thể thường gây nổ trong tự nhiên. Ảnh: Tor Paulin/flickr.
Hiện tượng đó sẽ tiếp diễn đến khi kim loại natri không còn, hoặc cho đến khi natri bị hoà tan hoàn toàn ở dạng ion hoá trong phần nước còn lại. Đó không chỉ là hoá học, đó còn là khoa học vật lý lượng tử cơ bản khiến mọi thứ khả thi.
Chính các quy tắc chi phối hành vi của từng phản ứng hoá học này phát sinh từ những định luật còn cơ bản hơn:
Thường thì bạn không thể truy nguyên mọi hành vi của một hệ thống phức tạp từ những quy tắc đơn giản, cơ bản làm nền tảng cho thành phần cấu tạo của nó, nhưng trong trường hợp của natri phản ứng với nước, chúng ta có thể làm vậy. Nếu không có các định luật vật lý và các lực vật lý này, chúng ta sẽ chẳng có hoá học! Nhưng nhờ có chúng, bất kể khi nào bạn cho natri vào nước, bạn đều biết chính xác hiện tượng sẽ xảy ra. Và nếu bạn vẫn chưa biết điều gì sẽ xảy ra khi cho natri vào nước, câu trả lời là hãy mặc thiết bị bảo hộ, đừng cầm nắm natri bằng đôi tay ướt nước của bạn, và đứng lùi ra một khoảng cách an toàn trong lúc phản ứng diễn ra!

Đặt một miếng kim loại natri tiếp xúc với nước sẽ tạo ra một phản ứng dữ dội, và thường phát nổ. Đó là vì natri đã góp một electron cho các ion hydro trong nước, dẫn tới toả nhiệt và tạo khí hydro. Khi khí hydro kết hợp với oxi trong không khí với sức nóng lúc bấy giờ, phản ứng cháy nổ sẽ xảy ra. Ảnh: Tavoromann/Wikimedia Commons.
Có hơi nghịch lý một chút: Khi chúng ta bắt gặp một thứ gì đó ngoài mong đợi lần đầu tiên, ta sẽ thắc mắc tại sao nó xảy ra theo cách đó. Nhưng nếu ta bắt gặp một hiện tượng thường thấy, ngay cả khi nó khiến ta ngạc nhiên và thốt lên tìm lời giải thích, thì ta chỉ đang chấp nhận rằng đó là cách thế giới này vận hành.
Cho một tinh thể muối – natri clorua đơn giản – vào nước, thì nó chỉ hoà tan.
Cho clo vào nước, bạn có thể khử trùng nước: diệt vi khuẩn, virus và các vi sinh vật gây bệnh khác có trong nước.
Nhưng nếu bạn cho natri vào nước thì sao? Phản ứng theo sau dữ dội đến khó quên.
Ngay khi bạn nhúng ướt miếng kim loại, phản ứng sẽ sủi bọt và nóng lên, natri nhảy quanh trên bề mặt nước, thậm chí còn sinh ra lửa. Hẳn rồi, đó chỉ là hoá học. Nhưng ở cấp độ cơ bản, có một hiện tượng nữa đang góp mặt: phản ứng lượng tử diễn ra giữa kim loại natri và phân tử nước (và các ion phân ly của nó) có thể xảy ra ngay sau đó. Dù rất muốn nói “đó chỉ là hoá học thôi mà”, nhưng nguyên nhân vật lý đằng sau phản ứng này lại rất hấp dẫn và chứa đựng nhiều thông tin, nhắc nhở ta đừng thôi hiếu kỳ về ngay cả hiện tượng bình thường này mà ta đã quá quen thuộc trong vũ trụ.
Dù có nhiều cách để nghĩ về nguyên tử, nhưng phản ứng hoá học diễn ra giữa natri và nước lại hợp lý nhất khi bạn cho rằng nguyên tử là “khí hiếm” với các proton thừa trong hạt nhân và electron thừa trong lớp vỏ hoá trị của chúng. Ví dụ, natri rất giống khí hiếm neon, nguyên tố thứ 10 trong bảng tuần hoàn, có 10 proton trong hạt nhân và có hai orbital đầu tiên (1s, với 2 electron) và thứ hai (2s, với 2 electron và 2p, với 6 electron) được lấp đầy bởi tổng cộng 10 electron.
Khí hiếm có tiếng là không phản ứng với bất kỳ chất nào, nguyên nhân là tất cả các orbital nguyên tử của nó đều đã chứa đủ các electron. Cấu trúc siêu ổn định này bị phá huỷ khi bạn tăng lên một nguyên tố trong bảng tuần hoàn, và điều đó xảy ra với mọi nguyên tố phù hợp với kiểu mẫu này, kể cả natri. Với một proton nữa trong hạt nhân, những orbital được lấp đầy hết electron sẽ được giữ chặt hơn, nhưng electron hoá trị thêm vào cuối cùng lại được giữ rất lỏng lẻo. Khí heli siêu ổn định, nhưng liti lại rất hoạt động. Neon ổn định, nhưng natri thì hoạt động. Tương tự argon, krypton và xenon ổn định, nhưng kali, rubidi và cesi hoạt động.

Bảng tuần hoàn các nguyên tố được sắp xếp như vậy (theo chu kỳ hàng và nhóm cột) là bởi số electron hoá trị tự do/chiếm ngự là yếu tố số một trong việc xác định tính chất hoá học của mỗi nguyên tử. Ảnh: Adobe Stock.
Nguyên nhân của khả năng phản ứng cực hạn này là gì? Đó là electron bổ sung.
Khi chúng ta học về nguyên tử, chúng ta được dạy hạt nhân là một lõi cứng, nhỏ, tích điện dương nằm ở trung tâm, và electron là các điểm tích điện âm quay quanh nó. Nhưng trong vật lý lượng tử, đó chỉ là một phần câu chuyện. Electron có thể hoạt động như một điểm, cụ thể nếu bạn bắn một hạt mang năng lượng cao khác hay photon vào electron, và để mặc cho hiện tượng xảy ra, chúng sẽ lan rộng và hoạt động như sóng. Sóng đó có thể tự cấu trúc theo những kiểu hình cụ thể:
- hình cầu (đối với orbital s, mỗi orbital 2 electron),
- vuông góc (đối với orbital p, mỗi orbital 6 electron),
- và cứ như vậy đến orbital d (10 electron),
- orbital f (14 electron),

Orbital nguyên tử ở trạng thái cơ bản (góc trên bên trái), cùng với các trạng thái năng lượng thấp nhất kế tiếp khi bạn tiến dần sang phải rồi đi xuống. Những cấu trúc cơ bản này chi phối cách hoạt động của nguyên tử và lực tác dụng liên nguyên tử. Ảnh: Atomic Orbital/ English Wikipedia).
Nguyên nhân những lớp vỏ này đầy là do Nguyên lý loại trừ Pauli, ngăn bất kỳ hai fermion giống nhau nào (giống như electron) chiếm giữ cùng một trạng thái lượng tử. Bởi vì các electron sở hữu một tính chất cơ học lượng tử cơ bản gọi là spin – một đơn vị đo động lượng góc nội tại của electron. Một spin của electron có thể là +½ hoặc -½, mỗi trạng thái lượng tử duy nhất có thể có hai electron bên trong: một electron có spin +½ và một electron có spin -½.
Trong một nguyên tử, khi lớp vỏ electron hay orbital đầy hết, nơi duy nhất để đặt vào một electron bổ sung là ở orbital kế tiếp. Một nguyên tử như clo hay flo sẽ sẵn sàng nhận một electron bổ sung, vì nó chỉ cần thêm một eletron nữa để lấp đầy lớp vỏ electron; ngược lại, một nguyên tử như natri hay kali sẽ sẵn sàng nhường electron ngoài cùng của nó, vì nó thừa một electron hơn là cần lấp đầy lớp vỏ. Đó là lý do natri clorua (NaCl) là một loại muối tốt đến vậy: natri nhường clo một electron, và cả hai nguyên tử sau đó tồn tại ở cấu trúc có lợi hơn về mặt năng lượng.

Biểu đồ cho thấy năng lượng ion hoá đầu tiên của mỗi nguyên tử trong bảng tuần hoàn xếp theo số nguyên tử. Đây là lượng năng lượng mà nguyên tử cần để tách electron được giữ lỏng lẻo nhất ra khỏi nguyên tử hoàn toàn, và ion hoá nguyên tử. Các nguyên tố trong nhóm đầu tiên của bảng tuần hoàn, như liti, natri, kali, rubidi v.v… mất electron đầu tiên dễ hơn nhiều so với các nguyên tố khác. Ảnh: Glrx/Wikimedia Commons.
Thực ra, lượng năng lượng cần thiết để một nguyên tử trung tính nhường electron lớp ngoài cùng, hay còn gọi là năng lượng điện hoá đầu tiên, rất thấp đối với các kim loại có một electron hoá trị. Nếu bạn nhìn vào những con số này, thì việc tách một electron đơn lẻ ra khỏi liti, natri, kali, rubudi, cesi, v.v… dễ hơn nhiều so với các nguyên tử khác.
Hơn nữa, khi ta nhìn vào các nguyên tố nặng dần hơn – những nguyên tố có số proton lớn hơn trong hạt nhân, và do đó sẽ có số orbital được lấp đầy hết nhiều hơn – ta sẽ thấy năng lượng ion hoá tổng thể giảm mạnh.
Tính chất ấy đóng vai trò quan trọng trong sự hình thành sao mới, dù bạn có tin hay không. Khi các sao đầu tiên hình thành, vũ trụ chỉ chứa hydro và heli khó ion hoá, nên nếu bạn không nung nóng những nguyên tố đó đến nhiệt độ đủ nóng để ion hoá chúng, thì chúng sẽ làm nguội những đám mây khí rất chậm. Điều đó dẫn tới những đám mây khối lượng lớn hình thành nên các sao khối lượng lớn; sau đó khi vũ trụ đã có nhiều nguyên tố nặng hơn, quá trình làm mát xảy ra dễ hơn do những nguyên tử dễ ion hoá dồi dào. Sau đó các sao có thể hình thành từ những đám mây khối lượng thấp hơn, tạo ra những sao khối lượng nhỏ hơn trước.

Ảnh minh hoạ tương tác giữa các phân tử nước với nhau. Nước là một phân tử dạng chữ V, có một mặt tích điện âm (vị trí nguyên tử oxi) và hai đầu tích điện dương (vị trí hai nguyên tử hydro). Các phân tử nước lân cận tương tác với nhau bằng liên kết hydro, được thể hiện bằng đường nét chấm trong ảnh. Ảnh: Wikimedia Commons.
Vậy điều gì sẽ xảy ra khi bạn cho một nguyên tử natri – một nguyên tử natri dễ bị ion hoá, chỉ giữ electron lớp ngoài cùng rất yếu ớt – vào nước?
Có thể bạn nghĩ bản thân nước là một phân tử rất ổn định: H2O, với hai hydro liên kết với một oxi. Nhưng nước là một phân tử rất phân cực, nghĩa là một mặt của phân tử H2O (mặt bên kia hai hydro) có điện tích âm, trong khi mặt đối diện có điện tích dương.
Điều đó nghĩa là mỗi phân tử nước có một đầu “tích điện âm”, nơi có oxi, và một đầu “tích điện dương” đối diện. Khi bạn có nước thể lỏng, những phân tử đó sẽ xếp thành hàng tương đối với nhau theo cách sao cho thế năng điện là nhỏ nhất, và đầu âm của phân tử nước này có thể hút đầu dương của phân tử nước khác. Đó là một hiệu ứng đủ khiến một số phân tử nước – khoảng một phần vài triệu – phân ly thành hai ion: một proton (H+) và một ion hydroxyl (OH-).

Với sự có mặt của nhiều phân tử nước phân cực cao, cứ vài triệu phân tử nước sẽ có một phân tử tách thành ion hydroxyl và proton tự do, thông qua quá trình tự phân giải. Ảnh: Cdang/Wikimedia Commons.
Hiện tượng trên có nhiều hệ quả đối với những chất như axit hoặc bazo, muối hoà tan, kích hoạt phản ứng hoá học, v.v… Nhưng điều gì sẽ xảy ra khi bạn đã có nước tinh khiết rồi, nhưng cấu tạo không chỉ từ H2O mà còn chứa một phần trăm ít ỏi (thấp hơn 0,0001%) cả proton (H+) và ion hydroxyl (OH-), và sau đó bạn thêm natri trung tính vào nó?
Natri, nguyên tử trung tính này có một electron lớp ngoài cùng lỏng lẻo, giờ đang nằm trong nước: nước trung tính nhưng phân cực, proton tự do và ion hydroxyl. Câu hỏi chúng ta phải đặt ra là cấu trúc nào có lợi nhất về mặt năng lượng?
- Natri có nhường electron ngoài cùng của nó cho nước trung tính không?
- Natri có nhường electron ngoài cùng của nó cho ion hydroxyl không?
- Natri có nhường electron ngoài cùng của nó cho proton tự do không?
- Hoặc natri có giữ electron ngoài cùng của nó, hay thậm chí là lấy một electron từ một phần tử khác hay không?
Câu trả lời không cần phải động não; trong hầu hết mọi trường hợp, electron sẽ nhảy từ nguyên tử natri sang proton đơn lẻ đầu tiên mà nó tìm thấy.

Khi mất một electron, ion natri sẽ vui vẻ hoà tan trong nước, tương tự ion clo cũng vậy khi có được một electron. Điều đó sẽ có lợi hơn nhiều về mặt năng lượng cho electron đó, trong trường hợp của natri, là khi bắt cặp với một ion hydro (một proton tự do). Ảnh: RockEDU/Đại học Rockefeller.
Thực ra chẳng có gì là khó khăn ở đây. Ở quy mô nguyên tử và ion đơn lẻ, chúng ta thường tìm câu trả lời cho những câu hỏi như “Cần bao nhiêu năng lượng để ion hoá một electron?” hay “Bao nhiêu năng lượng được giải phóng khi một electron tìm thấy một ion và tạo thành một nguyên tử trung tính ở trạng thái cơ bản?” về năng lượng trên thang đo electron-vôn (eV). Tốn nhỉnh hơn 5 eV năng lượng để ion hoá một nguyên tử natri trung tính, và khi một ion natri có được một electron, nó cũng giải phóng ~5 eV năng lượng. Nhưng cần hơn 13 eV năng lượng để ion hoá hydro trung tính, và cũng 13 eV năng lượng đó được giải phóng khi một ion hydro trung tính trở lại.
Đó là lý do phản ứng xảy ra rất nhanh khi kim loại natri được thả vào nước, và nó toả ra rất nhiều năng lượng. Trên thực tế, khi electron được natri nhường đi bắt đầu kết hợp với ion hydro, nước trung tính sẽ phân ly nhiều hơn thành những proton tự do và ion hydroxyl, tạo ra càng nhiều hơn “nhiên liệu” để natri phản ứng.
Nhưng đó cũng không phải là toàn bộ câu chuyện. Vì nguyên tử hydro trung tính đã được tạo ra, nên chúng không chỉ hình thành một khối các nguyên tử đơn lẻ có thể liên kết với nhau như kim loại natri. Thay vào đó, ở nhiệt độ phòng và áp suất phòng, hydro là một chất khí, và đi đến một trạng thái thậm chí còn có lợi hơn về mặt năng lượng: hình thành nên phân tử hydro trung tính, H2. Nên giờ đây bạn sẽ có rất nhiều năng lượng tự do (vốn đã chuyển thành nhiệt lượng xung quanh các phân tử), khí hydro trung tính thoát ra từ dung dịch chất lỏng và đi vào không khí, vốn chủ yếu là khí nito (N2) và oxi (O2) trung tính.

Máy ảnh từ xa chụp cận cảnh động cơ chính của tàu con thoi trong buổi phóng thử nghiệm tại Trung tâm Vũ trụ John C. Stennis. Khí hydro được ưa dùng làm nguồn nhiên liệu trong tên lửa vì khối lượng phân tử nhẹ và có thể phản ứng với lượng oxi dồi dào trong khí quyển. Ảnh: NASA.
Bạn nhận ra công thức quen thuộc chưa?
Bạn có nhiều năng lượng tự do dưới dạng nhiệt. Bạn có khí hydro phân tử, và bạn có khí oxi phân tử.
Đó chính là công thức để đốt động cơ! Đốt cháy hydro/oxi là một phần quan trọng của nhiên liệu tên lửa, của phương tiện pin hydro và thảm hoạ Hindenberg nổi danh. (Cũng là lý do ngày nay ta lấp đầy các khí cầu bằng khí heli trơ thay vì khí hydro dễ cháy!)
Khi oxi và hydro phản ứng với sự góp mặt của năng lượng, phản ứng nổ dữ dội này sẽ sinh ra hơi nước, nhưng cũng toả ra nhiều năng lượng hơn. Điều đó giải thích tại sao khi bạn cho một miếng natri đủ lớn (hay bất kỳ nguyên tố nhóm 1 nào từ bảng tuần hoàn) vào nước, bạn sẽ nhận được năng lượng giải phóng phát nổ kinh khủng. Đó đều là do sự chuyển giao electron, xảy ra bởi các quy tắc lượng tử chi phối vũ trụ và các tính chất điện từ của các hạt tích điện cấu tạo nên nguyên tử và ion.

Mức năng lượng và hàm sóng electron tương ứng với các trạng thái khác nhau trong một nguyên tử hydro, dù cấu trúc là cực kỳ giống nhau đối với mọi nguyên tử. Mức năng lượng được lượng tử hoá theo bội số của hằng số Planck, nhưng ngay cả ở mức năng lượng thấp nhất thì trạng thái cơ bản cũng có hai cấu trúc khả thi phụ thuộc vào spin electron/proton tương đối. Ảnh: PoorLeno/Wikimedia Commons.
Tóm lại, khi bạn cho một miếng natri vào nước, đây là hiện tượng sẽ xảy ra.
- Đầu tiên, natri ngay lập tức nhường electron lớp ngoài cùng cho dung dịch chất lỏng là nước.
- Kế đến, electron đó bị ion hydro hấp thu, tạo nên nguyên tử hydro trung tính.
- Phản ứng ban đầu đó giải phóng một lượng lớn năng lượng tự do, khiến cho các phân tử xung quanh nóng lên.
- Ngay sau đó, nguyên tử hydro trung tính liên kết với nhau để nhanh chóng tạo thành nhiều phân tử khí hydro.
- Khí hydro nhẹ hơn và không đặc bằng các chất khí khác trong khí quyển, nên nó bay ra khỏi dung dịch chất lỏng.
- Và cuối cùng, nếu có đủ năng lượng, khí oxi trong không khí sẽ phản ứng với khí hydro, tạo ra một phản ứng cháy.

Một thỏi kim loại natri trông khá bình thường. Nhưng bạn không được chạm vào bằng tay trần, cũng không được để nó bị ướt trừ khi bạn đã chuẩn bị đón nhận hậu quả. Natri rất hoạt động đối với nước, và kết quả là có thể thường gây nổ trong tự nhiên. Ảnh: Tor Paulin/flickr.
Hiện tượng đó sẽ tiếp diễn đến khi kim loại natri không còn, hoặc cho đến khi natri bị hoà tan hoàn toàn ở dạng ion hoá trong phần nước còn lại. Đó không chỉ là hoá học, đó còn là khoa học vật lý lượng tử cơ bản khiến mọi thứ khả thi.
Chính các quy tắc chi phối hành vi của từng phản ứng hoá học này phát sinh từ những định luật còn cơ bản hơn:
- định luật vật lý lượng tử, gồm có nguyên lý loại trừ Pauli chi phối hành vi của electron trong nguyên tử,
- và định luật của thuyết điện từ trường cổ điển chi phối cách phản ứng của các hạt tích điện.
Thường thì bạn không thể truy nguyên mọi hành vi của một hệ thống phức tạp từ những quy tắc đơn giản, cơ bản làm nền tảng cho thành phần cấu tạo của nó, nhưng trong trường hợp của natri phản ứng với nước, chúng ta có thể làm vậy. Nếu không có các định luật vật lý và các lực vật lý này, chúng ta sẽ chẳng có hoá học! Nhưng nhờ có chúng, bất kể khi nào bạn cho natri vào nước, bạn đều biết chính xác hiện tượng sẽ xảy ra. Và nếu bạn vẫn chưa biết điều gì sẽ xảy ra khi cho natri vào nước, câu trả lời là hãy mặc thiết bị bảo hộ, đừng cầm nắm natri bằng đôi tay ướt nước của bạn, và đứng lùi ra một khoảng cách an toàn trong lúc phản ứng diễn ra!
Dịch bởi Kenhsinhvien.vn
(Theo Big Think)
(Theo Big Think)