- Tham gia
- 25/11/2012
- Bài viết
- 351
**Bài viết cập nhật đến ngày 19/8/2021
(kenhsinhvien.vn) Các nhà khoa học trên khắp thế giới đang làm việc nhanh hơn bao giờ hết nhằm chế tạo và sản xuất vắc xin có thể ngăn chặn sự lan rộng của COVID-19. Kể từ khi chủng coronavirus mới này xuất hiện vào tháng 12/2019, 20 loại vắc xin đã bắt đầu được triển khai ở nhiều quốc gia trên toàn cầu. Dưới đây là tổng quan về các loại vắc xin đang được sử dụng.
Trước khi các loại vắc xin được thử nghiệm lâm sàng trên người, chúng phải trải qua các thử nghiệm giai đoạn 1 chủ yếu để kiểm tra tính an toàn của vắc xin, xác định liều lượng và bất kỳ tác dụng phụ tiềm ẩn nào trên một số lượng nhỏ người tiêm. Thử nghiệm giai đoạn 2 khám phá nhiều hơn về tính an toàn và bắt đầu nghiên cứu tính hiệu quả trên nhóm người lớn hơn. Thử nghiệm giai đoạn 3, vốn ít loại vắc xin đến được giai đoạn này, lớn hơn nhiều, với sự tham gia của hàng ngàn hoặc hàng chục ngàn người, nhằm xác nhận và đánh giá tính hiệu quả của vắc xin và kiểm tra xem có bất kỳ tác dụng phụ hiếm gặp nào chỉ xuất hiện trong các nhóm lớn hay không. Giai đoạn cuối cùng, thử nghiệm giai đoạn 4, được tiến hành sau khi được cơ quan quản lý quốc gia phê duyệt và liên quan đến việc giám sát kỹ lưỡng hơn một quần thể dân cư rộng lớn qua một khoảng thời gian dài theo hình thức giám sát hậu thị trường (còn gọi là cảnh giác dược). Tuy nhiên, không phải mọi loại vắc xin được phê duyệt sử dụng trong nước đều đang được thử nghiệm giai đoạn 4. Các cơ quan quản lý ở nhiều quốc gia có các thủ tục và thời hạn riêng để cấp phép sử dụng khẩn cấp, dựa trên nhiều bằng chứng tại các giai đoạn thử nghiệm lâm sàng khác nhau. Một số cơ quan quản lý quốc gia, gồm cả ở Nga và Trung Quốc, đã bắt đầu phê duyệt vắc xin cho sử dụng cộng đồng (giới hạn hoặc rộng rãi) thậm chí trước cả khi thử nghiệm giai đoạn 3 được hoàn thành.
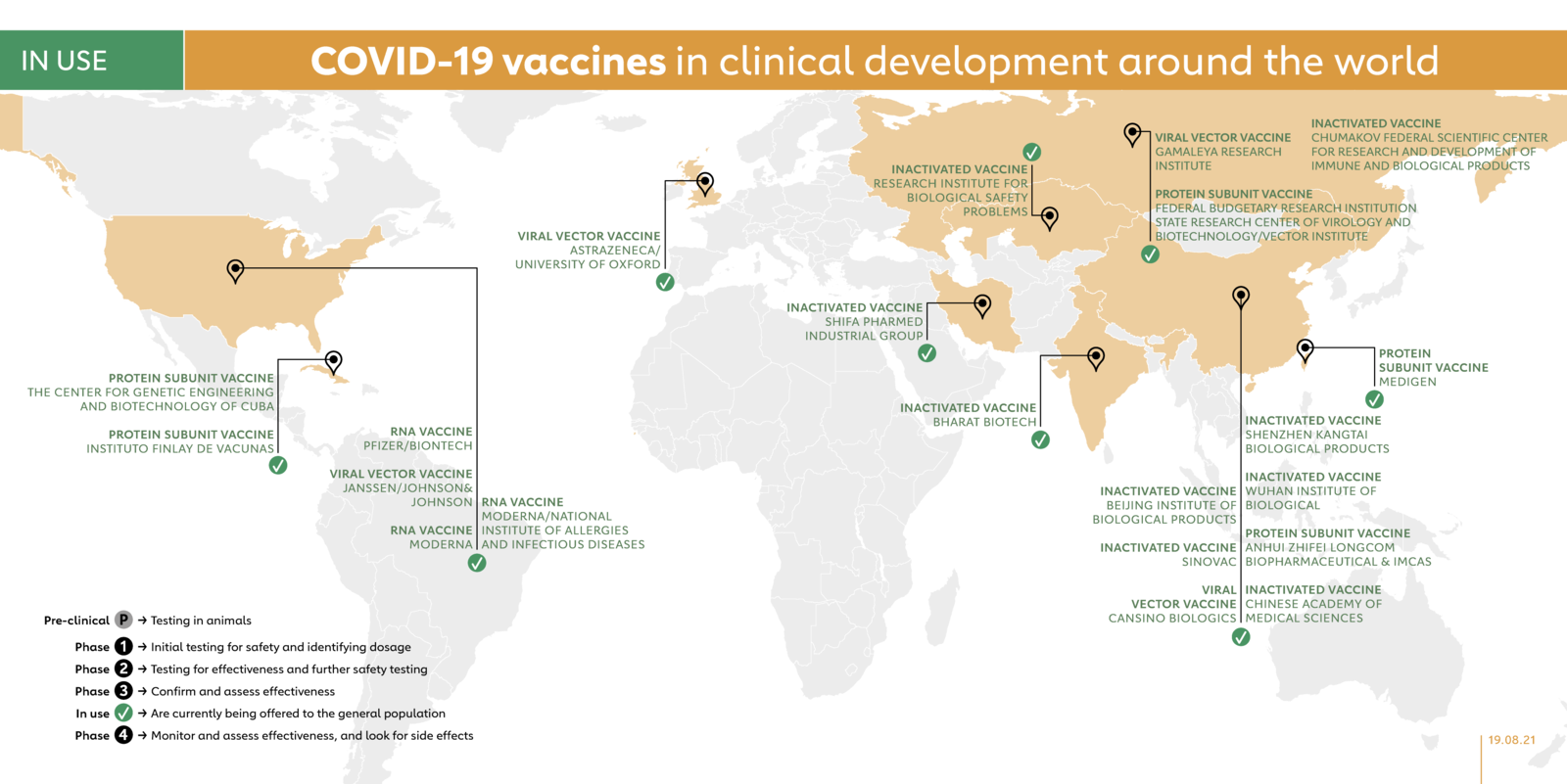
ASTRAZENECA/ĐẠI HỌC OXFORD (ANH)
Vắc xin vector virus
Vắc xin ChAdOx1, do AstraZeneca/Đại học Oxford chế tạo, có tính hiệu quả lên đến 90%. Anh và Argentina là những quốc gia đầu tiên cấp phép khẩn cấp loại vắc xin này vào tháng 12/2020. Sau đó là Ấn Độ (phê duyệt phiên bản Covishield của ChAdOx1 do Viện Huyết thanh Ấn Độ sản xuất), Brazil, Mexico, Pakistan cũng như Cơ quan Dược phẩm châu Âu. Vào tháng 2, WHO đã ban bố Danh sách Sử dụng Khẩn cấp (EUL) cho 2 phiên bản vắc xin COVID-19 của AstraZeneca/Oxford, được sản xuất bởi AstraZeneca-SKBio (Hàn Quốc) và Viện Huyết thanh Ấn Độ. Covishield và AstraZeneca-SKBio đều là những loại vắc xin nằm trong danh mục COVAX.
PFIZER/BIONTECH (ĐỨC)
Vắc xin RNA
Trong phân tích tính hiệu quả sau cùng của vắc xin, dữ liệu của BioNTech và Pfizer đã cho thấy tính hiệu quả là 95%. Ngày 2/12/2020, Anh trở thành quốc gia đầu tiên trên thế giới cấp phép khẩn cấp vắc xin của BioNTech và Pfizer, động thái này đã được nhiều nước khác nối gót. Ngày 31/12, WHO đã phê duyệt vắc xin Pfizer/BioNTech, BNT162, Danh sách Sử dụng Khẩn cấp, khiến nó trở thành vắc xin đầu tiên được WHO phê duyệt kể từ khi công bố đại dịch. BNT162b2 là một trong những vắc xin có trong danh mục COVAX.
MODERNA (HOA KỲ)
Vắc xin RNA
Moderna bắt đầu các thử nghiệm giai đoạn 3 vào tháng 7/2020 và kết quả thử nghiệm cuối cùng đã xác nhận vắc xin mRNA-1273 của công ty có tỷ lệ hiệu quả là 94%. Ngày 18/12/2020, nó trở thành vắc xin COVID-19 thứ hai được cấp phép bởi Cơ quan quản lý Thực phẩm và Dược phẩm (FDA) Hoa Kỳ, sau một tuần kể từ khi vắc xin của Pfizer và BioNTech được cấp phép. Ngày 30/4/2021, mRNA-1273 trở thành vắc xin thứ 5 được WHO cấp phép khẩn cấp. MRNA-1273 là một trong những vắc xin có trong danh mục COVAX.
JANSSEN/JOHNSON&JOHNSON (HOA KỲ)
Vắc xin vector virus
Tháng 1, công ty tuyên bố rằng vắc xin Ad26.COV2.S của mình có hiệu quả 66% ở Mỹ Latin, 57% ở Nam Phi và 72% ở Hoa Kỳ, với 100% hiệu quả kháng lại bệnh nặng trong tất cả các thử nghiệm. Bahrain trở thành quốc gia đầu tiên cấp phép sử dụng khẩn cấp vắc xin ngày 25/2/2021, với sự tiếp bước của FDA ngày 27/2 và khiến vắc xin của Johnson & Johnson trở thành vắc xin COVID-19 thứ ba (và là vắc xin đầu tiên chỉ tiêm một liều) có mặt tại Hoa Kỳ. Ngày 12/3/2021, WHO đã đưa vắc xin Johnson & Johnson vào danh sách sử dụng khẩn cấp trên tất cả các quốc gia và danh sách triển khai COVAX, một ngày sau khi vắc xin được Cơ quan Dược phẩm châu Âu (EMA) cấp phép. Ad26.COV2.S là một trong những vắc xin có trong danh mục COVAX.
GAMALEYA (NGA)
Vắc xin vector virus
Ngày 2/2/2021, công ty công bố kết quả thử nghiệm giai đoạn 3, với tỷ lệ hiệu quả là 91,6% đối với vắc xin vector virus không tái tạo Sputnik V. Tháng 11/2020, chính phủ Nga đã bắt đầu cung cấp Sputnik V đến người dân. Ngày 22/12, Belarus trở thành quốc gia đầu tiên ngoài Nga đăng ký Sputnik V. Từ đó, các nước khác tiếp bước theo sau.
TRUNG TÂM NGHIÊN CỨU NHÀ NƯỚC VỀ VIRUS HỌC VÀ CÔNG NGHỆ SINH HỌC CỦA CƠ QUAN NGHIÊN CỨU NGÂN SÁCH LIÊN BANG/VIỆN VECTOR (NGA)
Vắc xin tiểu đơn vị protein
Viện Vector đã chế tạo vắc xin COVID-19 có tên gọi EpiVacCorona và hiện đang thử nghiệm giai đoạn 3. Ngày 14/10/2020, tổng thống Vladimir Putin tuyên bố rằng Nga đã phê duyệt EpiVacCorona, vắc xin COVID-19 thứ hai được phê duyệt tại Nga, sau vắc xin Sputnik V của Gamaleya. Belarus và Turkmenistan cũng đã cấp phép EpiVacCorona, được tiêm 2 liều cách nhau 21 ngày.
TRUNG TÂM KHOA HỌC LIÊN BANG CHUMAKOV VỀ NGHIÊN CỨU VÀ PHÁT TRIỂN MIỄN DỊCH VÀ SINH PHẨM (NGA)
Vắc xin bất hoạt
Ngày 20/2/2021, vắc xin nội địa thứ 3 chống COVID-19 được phê duyệt sử dụng trong nước ở Nga. Vắc xin CoviVac do Trung tâm Khoa học Liên bang về Nghiên cứu và Phát triển Miễn dịch và Sinh phẩm chế tạo.
BHARAT BIOTECH (ẤN ĐỘ)
Vắc xin bất hoạt
Phối hợp với Hội đồng Nghiên cứu Dược Ấn Độ và Viện Virus học Quốc gia, Bharat Biotech đã chế tạo ra vắc xin Covaxin dựa trên dạng bất hoạt của coronavirus. Ngày 3/2/2021, chính phủ Ấn Độ đã cấp phép sử dụng khẩn cấp cho Covaxin. Kể từ tháng 6/2021, Covaxin đã nhận được Giấp phép Sử dụng Khẩn cấp (EUA) ở 16 quốc gia, kể cả Philippines, Brazil, Ấn Độ, Mexico và Iran, cùng với sự chấp thuận của WHO đối với Thư Bày tỏ nguyện vọng (EoI) của Bharat Biotech cho danh mục sử dụng khẩn cấp.
SINOVAC (TRUNG QUỐC)
Vắc xin bất hoạt
Sinovac đã tiến hành thử nghiệm giai đoạn 3 cho vắc xin CoronaVac trên các tình nguyện viên tại Brazil, Indonesia và Thổ Nhĩ Kỳ. Tháng 1/2021, Indonesia, Thổ Nhĩ Kỳ và Brazil đã cấp phép sử dụng vắc xin này. Tháng 2/2021, Sinovac tuyên bố vắc xin của công ty đã được phê duyệt sử dụng cộng đồng ở Trung Quốc. Một số thử nghiệm giai đoạn 4 đã được tiến hành từ tháng 2/2021. Ngày 1/6/2021, WHO cấp phép sử dụng khẩn cấp vắc xin Sinovac-CoronaVac, cùng lúc đó, Cơ quan Dược phẩm châu Âu đã bắt đầu đánh giá trên diện rộng CoronaVac. CoronaVac đã được cấp phép ở 42 quốc gia và được tiêm chủng 2 liều cách nhau 14 ngày. CoronaVac là vắc xin có trong danh mục COVAX.
TẬP ĐOÀN CANSINO BIOLOGICS (TRUNG QUỐC)
Vắc xin vector virus
Vắc xin vector virus không tái tạo Ad5-nCoV của CanSino Biologics được hợp tác chế tạo cùng Viện Công nghệ Sinh học của Học viện Khoa học Quân đội. Ngày 25/6/2020, quân đội Trung Quốc ở Chile, Trung Quốc, Ecuador, Hungary, Malaysia, Mexico, Moldova, Pakistan đã phê duyệt vắc xin này trong 1 năm với tư cách là “thuốc đặc biệt cần thiết”, điều kỳ lạ là ở thời điểm đó, thử nghiệm giai đoạn 2 chưa có kết quả. Tháng 2/2021, Trung Quốc tuyên bố phê duyệt vắc xin Ad5-nCoV cho sử dụng cộng đồng, tương tự, Viện Dược phẩm và Dinh Dưỡng Quốc gia Hungary phê duyệt vắc xin của CanSino cho sử dụng cộng đồng vào tháng 3. Đây là loại vắc xin thứ 2 do Trung Quốc sản xuất được phê duyệt ở Hungary. Vào tháng 6, Argentina cũng đã cấp phép sử dụng khẩn cấp vắc xin này.
VIỆN SINH PHẨM BẮC KINH (TRUNG QUỐC)
Vắc xin bất hoạt
Viện Bắc Kinh là thành viên của Tập đoàn nhà nước Sinopharm của Trung Quốc, đã hợp tác chế tạo vắc xin BBIBP-CorV cùng với Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Trung Quốc. Trung Quốc đã cấp phép khẩn cấp cho Sinopharm vào mùa hè năm 2020, trong khi các Tiểu vương quốc Ả-rập Thống nhất (UAE) cấp phép vào tháng 12. Kể từ đó, một số quốc gia khác cũng đã cấp phép cho vắc xin này, kể cả Hungary, quốc gia châu Âu đầu tiên đưa vào sử dụng vắc xin do Trung Quốc sản xuất. WHO đã cấp phép sử dụng khẩn cấp cho BBIBP-CorV tháng 5/2021. Tháng 5/2021, BBIBP-CorV đã khởi động thử nghiệm giai đoạn 4 với lịch trình 3 liều khác nhau dành cho người từ 60 tuổi trở lên và từ 3-17 tuổi và lịch trình 2 liều dành cho người từ 18-59 tuổi. BBIBP-CorV là một trong những vắc xin trong danh mục COVAX.
VIỆN SINH PHẨM VŨ HÁN (TRUNG QUỐC)
Vắc xin bất hoạt
Viện Vũ Hán, thành viên của công ty sở hữu nhà nước Sinopharm, đã tiến hành thử nghiệm giai đoạn 3 vào tháng 7/2020 ở UAE, và ở Peru và Morocco tháng 8/2020. Ngày 25/2/2021, Trung Quốc tuyên bố phê duyệt vắc xin Vũ Hán cho sử dụng cộng đồng. UAE sau đó trở thành quốc gia nước ngoài đầu tiên phê duyệt vắc xin.
SINH PHẨM SHENZHEN KANGTAI/CÔNG TY TNHH CÔNG NGHỆ SINH HỌC MINHAI BẮC KINH (TRUNG QUỐC)
Vắc xin bất hoạt
Đối tác sản xuất phía Trung Quốc của AstraZeneca , Sinh Phẩm Shenzhen Kangtai đã sở hữu cho riêng mình vắc xin COVID-19 Vero Cells. Thử nghiệm giai đoạn 2 đã xác định nhóm tuổi từ 18-59 là nhóm tuổi thích hợp sử dụng vắc xin. Tháng 4/2021, công ty này đã đăng ký thử nghiệm giai đoạn 3, và tiến hành thử nghiệm vào tháng 5. Cũng trong tháng đó, chính phủ Trung Quốc đã cấp phép sử dụng khẩn cấp cho loại vắc xin này.
HỌC VIỆN KHOA HỌC DƯỢC TRUNG QUỐC, VIỆN SINH HỌC DƯỢC (TRUNG QUỐC)
Vắc xin bất hoạt
Thử nghiệm giai đoạn 2 bắt đầu từ tháng 7/2020 và thử nghiệm giai đoạn 3 sau đó trên 29.000 người tham gia vào tháng 12/2020. Tháng 6/2021, vắc xin này được cấp phép sử dụng khẩn cấp ở Trung Quốc và ước tính có từ 500 triệu đến 1 tỷ liều sẽ được sản xuất hàng năm nhờ vào việc mở rộng các nhà máy sản xuất gần đây.
DƯỢC PHẨM SINH HỌC ANHUI ZHIFEI, VIỆN VI SINH HỌC CỦA HỌC VIỆN KHOA HỌC TRUNG QUỐC (TRUNG QUỐC/UZBEKHISTAN)
Vắc xin tiểu đơn vị protein
Công ty Trung Quốc Anhui Zhifei Longcom và Viện Sinh Dược tại Học viện Khoa học Dược Trung Quốc đã hợp tác với nhau để sản xuất vắc xin. Vắc xin này đang thử nghiệm giai đoạn 3 trên 29.000 tình nguyện viên. Trung Quốc đã cấp phép sử dụng khẩn cấp vắc xin này tháng 3/2021, trở thành vắc xin COVID-19 thứ 5 được phê duyệt trong nước và vắc xin thứ 4 được phê duyệt sử dụng khẩn cấp trong nước. Nó cũng được Uzbekhistan cấp phép. Vắc xin gồm 3 liều được tiêm cách nhau 1 tháng. Vắc xin có thể được lưu trữ tại nhiệt độ tủ lạnh thông thường.
TRUNG TÂM KỸ THUẬT GEN VÀ CÔNG NGHỆ SINH HỌC CUBA (CUBA)
Vắc xin tiểu đơn vị protein
Cùng với vắc xin xịt mũi, Trung tâm Kỹ thuật Gen và Công nghệ Sinh học Cuba cũng đã tiến hành thử nghiệm giai đoạn 1/2 riêng biệt vào tháng 11/2020 cho vắc xin Abdala, được tiêm vào bắp. Tháng 2/2021, Trung tâm đã tiến hành thử nghiệm giai đoạn 2 cho vắc xin Abdala, và tháng 3 là thử nghiệm giai đoạn 3, với kế hoạch chiêu mộ hơn 40.000 người tham gia. Vắc xin được cấp phép sử dụng khẩn cấp tại Cuba và Venezuela.
INSTITUTO FINLAY DE VACUNAS (CUBA)
Vắc xin tiểu đơn vị protein
Tháng 10/2020, Instituto Finlay De Vacunas đã tiến hành thử nghiệm vắc xin COVID-19 Soberana 2 của mình. Tháng 12/2020, Viện bắt đầu thử nghiệm giai đoạn 2 và đạt được thoả thuận với Viện Pasteur Iran vào tháng 1/2021 để kiểm tra vắc xin ở thử nghiệm giai đoạn 3. Tháng 3, thử nghiệm giai đoạn 3 của vắc xin Soberana 2 được đăng ký. Vắc xin đã được sử dụng ở Cuba và được cấp phép sử dụng khẩn cấp ở Iran.
MEDIGEN (ĐÀI LOAN)
Vắc xin tiểu đơn vị protein
Công ty sản xuất vắc xin ở Đài Loan Medigen đã chế tạo ra vắc xin tiêm 2 liều được sản xuất từ protein gai và liều tăng cường của Dynavax. Công ty bắt đầu thử nghiệm giai đoạn 2 vào cuối tháng 1/2021 và dự kiến ghi danh 3.700 người tham gia độ tuổi từ 20 trở lên. Tháng 7, thử nghiệm giai đoạn 2 bắt đầu trên người có độ tuổi từ 12-18. Cũng trong tháng đó, thử nghiệm giai đoạn 3 được cấp phép ở Paraguay. Ngày 19/7, vắc xin này được cấp phép sử dụng khẩn cấp ở Đài Loan.
CÔNG NGHỆ SINH HỌC DƯỢC NANOGEN (VIỆT NAM)
Vắc xin tiểu đơn vị protein (Thử nghiệm giai đoạn 4)
Nanogen của Việt Nam đã bắt đầu thử nghiệm giai đoạn 1/2 vắc xin Nanocovax trên 620 người tham gia tháng 12/2020. Tháng 6/2021, công ty này đã đăng ký thử nghiệm giai đoạn 3 với 13.000 người tham gia.
Tìm hiểu thêm về các loại vắc xin:
https://kenhsinhvien.vn/t/vac-xin-covid-19-moi-dieu-ban-can-biet.812435/
(kenhsinhvien.vn) Các nhà khoa học trên khắp thế giới đang làm việc nhanh hơn bao giờ hết nhằm chế tạo và sản xuất vắc xin có thể ngăn chặn sự lan rộng của COVID-19. Kể từ khi chủng coronavirus mới này xuất hiện vào tháng 12/2019, 20 loại vắc xin đã bắt đầu được triển khai ở nhiều quốc gia trên toàn cầu. Dưới đây là tổng quan về các loại vắc xin đang được sử dụng.
Trước khi các loại vắc xin được thử nghiệm lâm sàng trên người, chúng phải trải qua các thử nghiệm giai đoạn 1 chủ yếu để kiểm tra tính an toàn của vắc xin, xác định liều lượng và bất kỳ tác dụng phụ tiềm ẩn nào trên một số lượng nhỏ người tiêm. Thử nghiệm giai đoạn 2 khám phá nhiều hơn về tính an toàn và bắt đầu nghiên cứu tính hiệu quả trên nhóm người lớn hơn. Thử nghiệm giai đoạn 3, vốn ít loại vắc xin đến được giai đoạn này, lớn hơn nhiều, với sự tham gia của hàng ngàn hoặc hàng chục ngàn người, nhằm xác nhận và đánh giá tính hiệu quả của vắc xin và kiểm tra xem có bất kỳ tác dụng phụ hiếm gặp nào chỉ xuất hiện trong các nhóm lớn hay không. Giai đoạn cuối cùng, thử nghiệm giai đoạn 4, được tiến hành sau khi được cơ quan quản lý quốc gia phê duyệt và liên quan đến việc giám sát kỹ lưỡng hơn một quần thể dân cư rộng lớn qua một khoảng thời gian dài theo hình thức giám sát hậu thị trường (còn gọi là cảnh giác dược). Tuy nhiên, không phải mọi loại vắc xin được phê duyệt sử dụng trong nước đều đang được thử nghiệm giai đoạn 4. Các cơ quan quản lý ở nhiều quốc gia có các thủ tục và thời hạn riêng để cấp phép sử dụng khẩn cấp, dựa trên nhiều bằng chứng tại các giai đoạn thử nghiệm lâm sàng khác nhau. Một số cơ quan quản lý quốc gia, gồm cả ở Nga và Trung Quốc, đã bắt đầu phê duyệt vắc xin cho sử dụng cộng đồng (giới hạn hoặc rộng rãi) thậm chí trước cả khi thử nghiệm giai đoạn 3 được hoàn thành.

ASTRAZENECA/ĐẠI HỌC OXFORD (ANH)
Vắc xin vector virus
Vắc xin ChAdOx1, do AstraZeneca/Đại học Oxford chế tạo, có tính hiệu quả lên đến 90%. Anh và Argentina là những quốc gia đầu tiên cấp phép khẩn cấp loại vắc xin này vào tháng 12/2020. Sau đó là Ấn Độ (phê duyệt phiên bản Covishield của ChAdOx1 do Viện Huyết thanh Ấn Độ sản xuất), Brazil, Mexico, Pakistan cũng như Cơ quan Dược phẩm châu Âu. Vào tháng 2, WHO đã ban bố Danh sách Sử dụng Khẩn cấp (EUL) cho 2 phiên bản vắc xin COVID-19 của AstraZeneca/Oxford, được sản xuất bởi AstraZeneca-SKBio (Hàn Quốc) và Viện Huyết thanh Ấn Độ. Covishield và AstraZeneca-SKBio đều là những loại vắc xin nằm trong danh mục COVAX.
PFIZER/BIONTECH (ĐỨC)
Vắc xin RNA
Trong phân tích tính hiệu quả sau cùng của vắc xin, dữ liệu của BioNTech và Pfizer đã cho thấy tính hiệu quả là 95%. Ngày 2/12/2020, Anh trở thành quốc gia đầu tiên trên thế giới cấp phép khẩn cấp vắc xin của BioNTech và Pfizer, động thái này đã được nhiều nước khác nối gót. Ngày 31/12, WHO đã phê duyệt vắc xin Pfizer/BioNTech, BNT162, Danh sách Sử dụng Khẩn cấp, khiến nó trở thành vắc xin đầu tiên được WHO phê duyệt kể từ khi công bố đại dịch. BNT162b2 là một trong những vắc xin có trong danh mục COVAX.
MODERNA (HOA KỲ)
Vắc xin RNA
Moderna bắt đầu các thử nghiệm giai đoạn 3 vào tháng 7/2020 và kết quả thử nghiệm cuối cùng đã xác nhận vắc xin mRNA-1273 của công ty có tỷ lệ hiệu quả là 94%. Ngày 18/12/2020, nó trở thành vắc xin COVID-19 thứ hai được cấp phép bởi Cơ quan quản lý Thực phẩm và Dược phẩm (FDA) Hoa Kỳ, sau một tuần kể từ khi vắc xin của Pfizer và BioNTech được cấp phép. Ngày 30/4/2021, mRNA-1273 trở thành vắc xin thứ 5 được WHO cấp phép khẩn cấp. MRNA-1273 là một trong những vắc xin có trong danh mục COVAX.
JANSSEN/JOHNSON&JOHNSON (HOA KỲ)
Vắc xin vector virus
Tháng 1, công ty tuyên bố rằng vắc xin Ad26.COV2.S của mình có hiệu quả 66% ở Mỹ Latin, 57% ở Nam Phi và 72% ở Hoa Kỳ, với 100% hiệu quả kháng lại bệnh nặng trong tất cả các thử nghiệm. Bahrain trở thành quốc gia đầu tiên cấp phép sử dụng khẩn cấp vắc xin ngày 25/2/2021, với sự tiếp bước của FDA ngày 27/2 và khiến vắc xin của Johnson & Johnson trở thành vắc xin COVID-19 thứ ba (và là vắc xin đầu tiên chỉ tiêm một liều) có mặt tại Hoa Kỳ. Ngày 12/3/2021, WHO đã đưa vắc xin Johnson & Johnson vào danh sách sử dụng khẩn cấp trên tất cả các quốc gia và danh sách triển khai COVAX, một ngày sau khi vắc xin được Cơ quan Dược phẩm châu Âu (EMA) cấp phép. Ad26.COV2.S là một trong những vắc xin có trong danh mục COVAX.
GAMALEYA (NGA)
Vắc xin vector virus
Ngày 2/2/2021, công ty công bố kết quả thử nghiệm giai đoạn 3, với tỷ lệ hiệu quả là 91,6% đối với vắc xin vector virus không tái tạo Sputnik V. Tháng 11/2020, chính phủ Nga đã bắt đầu cung cấp Sputnik V đến người dân. Ngày 22/12, Belarus trở thành quốc gia đầu tiên ngoài Nga đăng ký Sputnik V. Từ đó, các nước khác tiếp bước theo sau.
TRUNG TÂM NGHIÊN CỨU NHÀ NƯỚC VỀ VIRUS HỌC VÀ CÔNG NGHỆ SINH HỌC CỦA CƠ QUAN NGHIÊN CỨU NGÂN SÁCH LIÊN BANG/VIỆN VECTOR (NGA)
Vắc xin tiểu đơn vị protein
Viện Vector đã chế tạo vắc xin COVID-19 có tên gọi EpiVacCorona và hiện đang thử nghiệm giai đoạn 3. Ngày 14/10/2020, tổng thống Vladimir Putin tuyên bố rằng Nga đã phê duyệt EpiVacCorona, vắc xin COVID-19 thứ hai được phê duyệt tại Nga, sau vắc xin Sputnik V của Gamaleya. Belarus và Turkmenistan cũng đã cấp phép EpiVacCorona, được tiêm 2 liều cách nhau 21 ngày.
TRUNG TÂM KHOA HỌC LIÊN BANG CHUMAKOV VỀ NGHIÊN CỨU VÀ PHÁT TRIỂN MIỄN DỊCH VÀ SINH PHẨM (NGA)
Vắc xin bất hoạt
Ngày 20/2/2021, vắc xin nội địa thứ 3 chống COVID-19 được phê duyệt sử dụng trong nước ở Nga. Vắc xin CoviVac do Trung tâm Khoa học Liên bang về Nghiên cứu và Phát triển Miễn dịch và Sinh phẩm chế tạo.
BHARAT BIOTECH (ẤN ĐỘ)
Vắc xin bất hoạt
Phối hợp với Hội đồng Nghiên cứu Dược Ấn Độ và Viện Virus học Quốc gia, Bharat Biotech đã chế tạo ra vắc xin Covaxin dựa trên dạng bất hoạt của coronavirus. Ngày 3/2/2021, chính phủ Ấn Độ đã cấp phép sử dụng khẩn cấp cho Covaxin. Kể từ tháng 6/2021, Covaxin đã nhận được Giấp phép Sử dụng Khẩn cấp (EUA) ở 16 quốc gia, kể cả Philippines, Brazil, Ấn Độ, Mexico và Iran, cùng với sự chấp thuận của WHO đối với Thư Bày tỏ nguyện vọng (EoI) của Bharat Biotech cho danh mục sử dụng khẩn cấp.
SINOVAC (TRUNG QUỐC)
Vắc xin bất hoạt
Sinovac đã tiến hành thử nghiệm giai đoạn 3 cho vắc xin CoronaVac trên các tình nguyện viên tại Brazil, Indonesia và Thổ Nhĩ Kỳ. Tháng 1/2021, Indonesia, Thổ Nhĩ Kỳ và Brazil đã cấp phép sử dụng vắc xin này. Tháng 2/2021, Sinovac tuyên bố vắc xin của công ty đã được phê duyệt sử dụng cộng đồng ở Trung Quốc. Một số thử nghiệm giai đoạn 4 đã được tiến hành từ tháng 2/2021. Ngày 1/6/2021, WHO cấp phép sử dụng khẩn cấp vắc xin Sinovac-CoronaVac, cùng lúc đó, Cơ quan Dược phẩm châu Âu đã bắt đầu đánh giá trên diện rộng CoronaVac. CoronaVac đã được cấp phép ở 42 quốc gia và được tiêm chủng 2 liều cách nhau 14 ngày. CoronaVac là vắc xin có trong danh mục COVAX.
TẬP ĐOÀN CANSINO BIOLOGICS (TRUNG QUỐC)
Vắc xin vector virus
Vắc xin vector virus không tái tạo Ad5-nCoV của CanSino Biologics được hợp tác chế tạo cùng Viện Công nghệ Sinh học của Học viện Khoa học Quân đội. Ngày 25/6/2020, quân đội Trung Quốc ở Chile, Trung Quốc, Ecuador, Hungary, Malaysia, Mexico, Moldova, Pakistan đã phê duyệt vắc xin này trong 1 năm với tư cách là “thuốc đặc biệt cần thiết”, điều kỳ lạ là ở thời điểm đó, thử nghiệm giai đoạn 2 chưa có kết quả. Tháng 2/2021, Trung Quốc tuyên bố phê duyệt vắc xin Ad5-nCoV cho sử dụng cộng đồng, tương tự, Viện Dược phẩm và Dinh Dưỡng Quốc gia Hungary phê duyệt vắc xin của CanSino cho sử dụng cộng đồng vào tháng 3. Đây là loại vắc xin thứ 2 do Trung Quốc sản xuất được phê duyệt ở Hungary. Vào tháng 6, Argentina cũng đã cấp phép sử dụng khẩn cấp vắc xin này.
VIỆN SINH PHẨM BẮC KINH (TRUNG QUỐC)
Vắc xin bất hoạt
Viện Bắc Kinh là thành viên của Tập đoàn nhà nước Sinopharm của Trung Quốc, đã hợp tác chế tạo vắc xin BBIBP-CorV cùng với Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Trung Quốc. Trung Quốc đã cấp phép khẩn cấp cho Sinopharm vào mùa hè năm 2020, trong khi các Tiểu vương quốc Ả-rập Thống nhất (UAE) cấp phép vào tháng 12. Kể từ đó, một số quốc gia khác cũng đã cấp phép cho vắc xin này, kể cả Hungary, quốc gia châu Âu đầu tiên đưa vào sử dụng vắc xin do Trung Quốc sản xuất. WHO đã cấp phép sử dụng khẩn cấp cho BBIBP-CorV tháng 5/2021. Tháng 5/2021, BBIBP-CorV đã khởi động thử nghiệm giai đoạn 4 với lịch trình 3 liều khác nhau dành cho người từ 60 tuổi trở lên và từ 3-17 tuổi và lịch trình 2 liều dành cho người từ 18-59 tuổi. BBIBP-CorV là một trong những vắc xin trong danh mục COVAX.
VIỆN SINH PHẨM VŨ HÁN (TRUNG QUỐC)
Vắc xin bất hoạt
Viện Vũ Hán, thành viên của công ty sở hữu nhà nước Sinopharm, đã tiến hành thử nghiệm giai đoạn 3 vào tháng 7/2020 ở UAE, và ở Peru và Morocco tháng 8/2020. Ngày 25/2/2021, Trung Quốc tuyên bố phê duyệt vắc xin Vũ Hán cho sử dụng cộng đồng. UAE sau đó trở thành quốc gia nước ngoài đầu tiên phê duyệt vắc xin.
SINH PHẨM SHENZHEN KANGTAI/CÔNG TY TNHH CÔNG NGHỆ SINH HỌC MINHAI BẮC KINH (TRUNG QUỐC)
Vắc xin bất hoạt
Đối tác sản xuất phía Trung Quốc của AstraZeneca , Sinh Phẩm Shenzhen Kangtai đã sở hữu cho riêng mình vắc xin COVID-19 Vero Cells. Thử nghiệm giai đoạn 2 đã xác định nhóm tuổi từ 18-59 là nhóm tuổi thích hợp sử dụng vắc xin. Tháng 4/2021, công ty này đã đăng ký thử nghiệm giai đoạn 3, và tiến hành thử nghiệm vào tháng 5. Cũng trong tháng đó, chính phủ Trung Quốc đã cấp phép sử dụng khẩn cấp cho loại vắc xin này.
HỌC VIỆN KHOA HỌC DƯỢC TRUNG QUỐC, VIỆN SINH HỌC DƯỢC (TRUNG QUỐC)
Vắc xin bất hoạt
Thử nghiệm giai đoạn 2 bắt đầu từ tháng 7/2020 và thử nghiệm giai đoạn 3 sau đó trên 29.000 người tham gia vào tháng 12/2020. Tháng 6/2021, vắc xin này được cấp phép sử dụng khẩn cấp ở Trung Quốc và ước tính có từ 500 triệu đến 1 tỷ liều sẽ được sản xuất hàng năm nhờ vào việc mở rộng các nhà máy sản xuất gần đây.
DƯỢC PHẨM SINH HỌC ANHUI ZHIFEI, VIỆN VI SINH HỌC CỦA HỌC VIỆN KHOA HỌC TRUNG QUỐC (TRUNG QUỐC/UZBEKHISTAN)
Vắc xin tiểu đơn vị protein
Công ty Trung Quốc Anhui Zhifei Longcom và Viện Sinh Dược tại Học viện Khoa học Dược Trung Quốc đã hợp tác với nhau để sản xuất vắc xin. Vắc xin này đang thử nghiệm giai đoạn 3 trên 29.000 tình nguyện viên. Trung Quốc đã cấp phép sử dụng khẩn cấp vắc xin này tháng 3/2021, trở thành vắc xin COVID-19 thứ 5 được phê duyệt trong nước và vắc xin thứ 4 được phê duyệt sử dụng khẩn cấp trong nước. Nó cũng được Uzbekhistan cấp phép. Vắc xin gồm 3 liều được tiêm cách nhau 1 tháng. Vắc xin có thể được lưu trữ tại nhiệt độ tủ lạnh thông thường.
TRUNG TÂM KỸ THUẬT GEN VÀ CÔNG NGHỆ SINH HỌC CUBA (CUBA)
Vắc xin tiểu đơn vị protein
Cùng với vắc xin xịt mũi, Trung tâm Kỹ thuật Gen và Công nghệ Sinh học Cuba cũng đã tiến hành thử nghiệm giai đoạn 1/2 riêng biệt vào tháng 11/2020 cho vắc xin Abdala, được tiêm vào bắp. Tháng 2/2021, Trung tâm đã tiến hành thử nghiệm giai đoạn 2 cho vắc xin Abdala, và tháng 3 là thử nghiệm giai đoạn 3, với kế hoạch chiêu mộ hơn 40.000 người tham gia. Vắc xin được cấp phép sử dụng khẩn cấp tại Cuba và Venezuela.
INSTITUTO FINLAY DE VACUNAS (CUBA)
Vắc xin tiểu đơn vị protein
Tháng 10/2020, Instituto Finlay De Vacunas đã tiến hành thử nghiệm vắc xin COVID-19 Soberana 2 của mình. Tháng 12/2020, Viện bắt đầu thử nghiệm giai đoạn 2 và đạt được thoả thuận với Viện Pasteur Iran vào tháng 1/2021 để kiểm tra vắc xin ở thử nghiệm giai đoạn 3. Tháng 3, thử nghiệm giai đoạn 3 của vắc xin Soberana 2 được đăng ký. Vắc xin đã được sử dụng ở Cuba và được cấp phép sử dụng khẩn cấp ở Iran.
MEDIGEN (ĐÀI LOAN)
Vắc xin tiểu đơn vị protein
Công ty sản xuất vắc xin ở Đài Loan Medigen đã chế tạo ra vắc xin tiêm 2 liều được sản xuất từ protein gai và liều tăng cường của Dynavax. Công ty bắt đầu thử nghiệm giai đoạn 2 vào cuối tháng 1/2021 và dự kiến ghi danh 3.700 người tham gia độ tuổi từ 20 trở lên. Tháng 7, thử nghiệm giai đoạn 2 bắt đầu trên người có độ tuổi từ 12-18. Cũng trong tháng đó, thử nghiệm giai đoạn 3 được cấp phép ở Paraguay. Ngày 19/7, vắc xin này được cấp phép sử dụng khẩn cấp ở Đài Loan.
CÔNG NGHỆ SINH HỌC DƯỢC NANOGEN (VIỆT NAM)
Vắc xin tiểu đơn vị protein (Thử nghiệm giai đoạn 4)
Nanogen của Việt Nam đã bắt đầu thử nghiệm giai đoạn 1/2 vắc xin Nanocovax trên 620 người tham gia tháng 12/2020. Tháng 6/2021, công ty này đã đăng ký thử nghiệm giai đoạn 3 với 13.000 người tham gia.
Tìm hiểu thêm về các loại vắc xin:
https://kenhsinhvien.vn/t/vac-xin-covid-19-moi-dieu-ban-can-biet.812435/